eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.25749
ARTÍCULO ORIGINAL
REPERCUSIÓN DEL ACÚFENO EN PACIENTES CON ENFERMEDAD DE MÉNIÈRE
Impact of Tinnitus in Patients with Ménière’s Disease
Estela Cristina PRIETO-MAILLO1; Sofía FERREIRA-CENDÓN2; María José FERNÁNDEZ-NAVA2; Ramón Antonio MARTÍNEZ-CARRANZA2; José Carlos GÓMEZ-SÁNCHEZ3; Ángel BATUECAS-CALETRÍO2
1Facultad de Medicina. Universidad de Salamanca. España.
2Complejo Asistencial Universitario de Salamanca. Servicio de Otorrinolaringología y Cirugía de cabeza y cuello. Unidad de Otoneurología.. Instituto de Investigación Biomédica de Salamanca (IBSAL). Salamanca. España.
3Complejo Asistencial Universitario de Salamanca. Servicio de Neurología. Instituto de Investigación Biomédica de Salamanca (IBSAL). Salamanca. España.
Correspondencia: sofi_ferreira@hotmail.com
Fecha de recepción: 8 de febrero de 2021
Fecha de aceptación: 6 de abril de 2021
Fecha de publicación: 8 de abril de 2021
Fecha de publicación del fascículo: 1 de septiembre 2021
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN
Introducción y objetivo: El acúfeno conforma junto con los episodios de vértigo, hipoacusia neurosensorial y la sensación de plenitud ótica los síntomas cardinales de la Enfermedad de Ménière. No alcanzando la importancia que le corresponde en el manejo de esta enfermedad, el acúfeno repercute profundamente en la vida de los pacientes, sobre todo en la esfera psicológica. Método: Se seleccionaron 15 pacientes con Enfermedad de Ménière diagnosticados según los criterios de la Sociedad de Bárány en Hospital Universitario de Salamanca. Se registraron variables específicas para el análisis de los síntomas cardinales de la enfermedad de Ménière. Se recogieron datos sobre la edad de aparición y años de evolución de la enfermedad y de la misma manera para el acúfeno, la afectación bilateral o unilateral de la misma y en este último supuesto, el oído afecto. Se sometió a los pacientes a estudio audiométrico junto con acufenometría. Se valoraron los principales parámetros definitorios del acúfeno: frecuencia (Hz), intensidad (dB), umbral de enmascaramiento (dB) e inhibición residual (segundos). Los pacientes realizaron el test Tinnitus Handicap Inventory (THI) y Escala visual analógica (VAS). La valoración de alteraciones en el estado de ánimo se obtuvo a través de la Escala Hospitalaria de Ansiedad y Depresión (HADS). Resultados: La edad media de diagnóstico de la Enfermedad de Ménière es 47,47 años. Las medias de pérdida auditiva en cada frecuencia por la enfermedad de Ménière se sitúan en torno a los 50 dB. El acúfeno no predomina en ninguno de los oídos (p>0,05). Se determinó una relación fuertemente significativa entre THI y VAS (r=0,72; p<0,01). Tanto THI como VAS no se relacionaron con los valores de la media de las pérdidas auditivas de ambos oídos. Los pacientes con más de dos años de evolución de la enfermedad se corresponden estadísticamente con puntuaciones mayores en THI y en la subescala de depresión del HADS (r= 0,821; p=0,001). Discusión: La intensidad del acúfeno, cuantificada de manera subjetiva con THI, no se relaciona con el grado de pérdida auditiva en los pacientes con Enfermedad de Ménière. El estudio de la esfera psicológica a través de la escala HADS demuestra la existencia de trastornos del ánimo en estos pacientes, prevaleciendo la patología depresiva en aquellos que presentan acúfenos de larga evolución.
PALABRAS CLAVE
Enfermedad de Méniere; acúfenos; depresión; ansiedad; pérdida auditiva
SUMMARY
Introduction and objective: Tinnitus, with concurrent episodes of vertigo, neurosensorial hearing loss and aural fullness are the cardinal symptoms of Ménière Disease. Not achieving the importance it deserves in the management of the disease, tinnitus has a relevant impact on the lives of patients, especially in the psychological sphere. Method: Fifteen patients with Ménière’s disease were selected according to the Bárány Society diagnostic criteria at the University Hospital of Salamanca. Specific variables were recorded for the analysis of the cardinal symptoms of Ménière’s disease. Facts about the age of onset and years of disease evolution were collected and in the same strategy for tinnitus, bilateral or unilateral involvement of the disease and in the latter case, the affected ear. Patients were subjected to audiometric test and tinnitus matching. The main parameters defining tinnitus were assessed: frequency (Hz), intensity (dB), minimum masking level (dB) and residual inhibition (seconds). Tinnitus Handicap Inventory (THI) and Visual Analogue Scale (VAS) were performed to determine tinnitus severity. The assessment of mental symptoms was obtained through the Hospital Anxiety and Depression Scale (HADS). Results: Ménière’s disease is diagnosed at the mean age of 47.47 years. The average hearing loss at each frequency due to Ménière’s disease is approximately 50 dB. Tinnitus is not prevailing in any of the ears (p>0.05). A significant correlation was found between THI and VAS (r=0.72; p<0.01). Both, THI and VAS, were not related to mean values of hearing loss in either ears. Patients with over two years of disease evolution are associated with higher scores on the THI and HADS depression subscales (r=0.821; p=0.001). Discussion: The intensity of tinnitus, quantified subjectively with THI, is not related to hearing loss in patients with Ménière’s disease. The study of the psychological sphere through the HADS demonstrates certain predominance of depressive pathology in patients who present longstanding tinnitus.
KEYWORDS
Mèniere’s disease; tinnitus; depression; anxiety; hearing loss
INTRODUCCIÓN
La enfermedad de Ménière (EM) es un trastorno del oído interno, que se presenta clínicamente como episodios espontáneos de vértigo y recurrentes, hipoacusia neurosensorial fluctuante, acúfenos y sensación de plenitud ótica [1, 2]. Su prevalencia oscila entre 50-200/100000 adultos y es más común entre la cuarta y sexta década de la vida [3]. Se produce por un aumento de volumen y presión de la endolinfa que en el laberinto anterior ocasiona hipoacusia y acúfenos; y en el laberinto posterior alteración del equilibrio. Este aumento de presión endolinfática repercute sobre los receptores sensoriales del oído interno situados en las paredes del laberinto membranoso, pudiendo romper la pared del laberinto, mezclando la endolinfa y perilinfa [4, 5].
Es de etiología desconocida, aunque se conocen factores de riesgo asociados como: anormalidades anatómicas, predisposición genética, alteraciones inmunológicas, lesiones vasculares laberínticas e incluso relación con virus herpes I y II o citomegalovirus [5].
Típicamente se presenta con sintomatología unilateral, aunque puede llegar a bilateralizarse, lo que agrava el pronóstico funcional [5].
La historia natural de la EM es progresiva y fluctuante. Los ataques de vértigo son más numerosos e intensos en los primeros y sus períodos de remisión varían de meses a años pudiendo llegar a desaparecer. Los ataques de vértigo se caracterizan por ser espontáneos, rotatorios, con una duración entre 20 minutos a varias horas, acompañados de cortejo vegetativo y nistagmo horizontorrotatorio [6].
El diagnóstico se basa en la clínica. Se debe descartar patología de origen central mediante exploración neurológica. En la audiometría se constata una hipoacusia neurosensorial con reclutamiento positivo predominando en graves en fases iniciales y evoluciona con el tiempo a una hipoacusia pantonal, estabilizándose en los 60-70 dB de pérdida [5, 6].
Actualmente, se consideran dos categorías diagnósticas: EM definida y probable [2].
La EM definida se caracteriza por:
A. Dos o más episodios de vértigo espontáneo, con una duración entre 20 minutos y 12 horas.
B. Hipoacusia neurosensorial de frecuencias bajas y medias documentada con audiometría en un oído, definiendo el oído afectado en al menos una ocasión antes, durante o después de uno de los episodios de vértigo.
C. Síntomas auditivos fluctuantes (hipoacusia, acúfenos o plenitud) en el oído afectado.
D. No existe otro diagnóstico vestibular que explique mejor los síntomas.
La EM probable presenta los siguientes aspectos:
A. Dos o más episodios de vértigo o mareo, con una duración entre 20 minutos y 24 horas.
B. Síntomas auditivos fluctuantes (hipoacusia, acúfenos o plenitud ótica) en el oído afectado.
C. No existe otro diagnóstico vestibular que explique mejor los síntomas.
Los objetivos del tratamiento de la EM son reducir los ataques de vértigo y mejorar la calidad de vida del paciente, incidiendo en factores desencadenantes, estilo de vida o dieta. El tratamiento farmacológico en la fase aguda de las crisis incluye sedantes vestibulares. Posterior a la misma se prescriben diuréticos que regulan el volumen endolinfático o agonistas parciales de receptor H1 como la betahistina [5].
El apoyo psicológico constituye una herramienta importante en el tratamiento del paciente con EM. Es de gran utilidad la realización de encuestas que evalúen la situación psicológica del paciente y su propia percepción sobre la enfermedad, como por ejemplo, la escala hospitalaria de ansiedad y depresión (Hospital Anxiety and Depresion Scale, HAD) [6].
Los acúfenos, problema cardinal de la EM, son el resultado de una actividad anómala en la vía auditiva desde la cóclea a la corteza cerebral. En la EM, la tonalidad es inicialmente de baja frecuencia, concordante con las características de la hipoacusia. Se explica por el daño provocado en la estría vascular, responsable de la producción de endolinfa. La alteración de la homeostasis de la endolinfa aumenta la concentración de K+ extracelular que rodea las dendritas aferentes del nervio auditivo, generando un aumento en las descargas neuronales. Los acúfenos pueden preceder a las crisis vertiginosas, incrementando su intensidad o tono durante la misma [6-8].
Diversos cuestionarios han sido utilizados para medir cuantitativa y cualitativamente el acúfeno, pero es el estudio de las características psicoacústicas del acúfeno (intensidad, frecuencia, nivel mínimo de enmascaramiento, inhibición residual) lo que nos permite conocer el impacto del mismo en la vida diaria del paciente [8-10]. El test más aceptado, Tinnitus Handicap Inventory (THI), analiza la función mental y social, el área emocional y la incapacidad del paciente y su propia percepción frente a la enfermedad [11].
En algunos estudios los acúfenos aparecen al inicio de la enfermedad en más de la mitad de los pacientes estudiados; y son descritos como el síntoma más molesto y problemático, sobre todo en aquellos pacientes con EM de larga evolución [1,12,13], asociándose a un menor nivel de calidad de vida relacionada con la enfermedad [14]. Pueden conducir a problemas psicológicos, como ansiedad o depresión [15-17]. También pueden generar dificultades en la comprensión verbal, alteraciones del sueño o problemas de concentración.
El acúfeno es responsable del cambio o abandono del trabajo en el 30% de los pacientes, mientras que el 15% se ve forzado a dejar de conducir [17-19]. Por todo ello, la adquisición de un mejor conocimiento de las características del acúfeno y sus asociaciones podría repercutir de manera directa en una mejora de la calidad de vida de estos pacientes.
Los objetivos de este estudio son conocer la intensidad del acúfeno, en base al THI, en una muestra aleatoria de pacientes con EM, comprender la repercusión, en términos de ansiedad y depresión, del acúfeno en pacientes con EM, a través de la HADS y estudiar si existe relación entre la pérdida de audición y la intensidad del acúfeno en pacientes con EM.
MATERIAL Y MÉTODO
Se realiza un estudio descriptivo prospectivo. Se recogen los datos de una muestra aleatoria de pacientes con EM diagnosticados según los criterios de la Sociedad de Bárány en Hospital Universitario de Salamanca. Se recogen las variables demográficas de edad, género y antecedentes familiares de EM. Dentro de las variables específicas se registran: edad de aparición de la enfermedad, años de evolución de la misma, enfermedad unilateral o bilateral y si es unilateral, el oído afecto.
Respecto a la hipoacusia, se registra el subtipo clínico (sincrónica o diacrónica), grado de hipoacusia según su audiometría tonal liminar (ATL), media de pérdida auditiva en frecuencias de 500, 1000, 2000 y 4000 Hz (Pure Tone Average, PTA).
Del acúfeno se tiene en cuenta la edad de aparición y años de evolución, afectación uni o bilateral y además se realiza una acufenometría que valora de manera psicoacústica la intensidad (dB), frecuencia a la que se localiza (Hz), tipo de ruido percibido, umbral de enmascaramiento (dB) e inhibición residual (segundos). Se elige el oído con mejor audición en el caso de acúfenos bilaterales o el oído contrario si es unilateral.
Por último, se determinan las variables escala: escala analógica visual (siglas en inglés: VAS), Tinnitus Handicap Inventory (THI), Hospital Anxiety and Depression Scale global (HADS) y desglose de subescalas ansiedad y depresión.
El THI permite al médico conocer el impacto psicológico del acúfeno en el paciente. El test consiste en 25 preguntas con tres opciones de respuesta cada una: sí, a veces, no. De acuerdo con las respuestas sumaremos con cada ítem: 4 puntos al sí, 2 puntos al a veces y 0 puntos al no, de manera que el total varía entre 0 y 100 puntos.
El cuestionario puede dividirse en tres subescalas: la funcional (11 ítems) valora la repercusión del acúfeno en la vida cotidiana del paciente en el ámbito de la función física y mental; la emocional (9 ítems) abarca las cuestiones afectivas que provocan los acúfenos, por ejemplo, rabia, frustración, depresión etc.; por último, la escala catastrófica (5 ítems) que nos permite conocer la desesperación del paciente, la incapacidad de soportar el acúfeno y su propia percepción sobre la enfermedad.
En el año 1999 la Asociación Británica de Otorrinolaringología estandarizó una guía para clasificar la severidad del acúfeno según los resultados de THI. La incapacidad debida a los acúfenos se divide en 5 grados:
• Grado 1, muy leve (THI 0 a 16): el paciente refiere el acúfeno en ambientes silenciosos, sin apenas perturbación y con fácil enmascaramiento.
• Grado 2, leve (THI 18 a 36): el paciente no percibe el acúfeno en su vida diaria, siendo enmascarado por el ruido ambiental.
• Grado 3, moderado (THI 38 a 56): el acúfeno no dificulta las actividades diarias del paciente, pero sí dificulta la conciliación del sueño y no es enmascarado por el ruido ambiente.
• Grado 4, severo (THI 58 a 76): el paciente percibe el acúfeno de manera constante, interfiere con su vida diaria, impide el descanso y actividades diarias.
• Grado 5, catastrófico (THI 78 a 100): empeoran los síntomas del grado 4, en especial la incapacidad de conciliar el sueño. En algunos casos, el paciente puede presentar patologías psiquiátricas.
Tras la valoración objetiva del acúfeno, se solicita al paciente que nos refleje de manera subjetiva la molestia que le provoca el mismo; y lo hacemos mediante la VAS. Ésta consiste en una línea de 10 cm para representar la experiencia dolorosa desde “ausencia de dolor” hasta “peor dolor imaginable”. El paciente debe marcar sobre la línea el punto que represente el dolor e incomodidad que le provoque el acúfeno. El examinador traduce la marca en un número marcado en el reverso. Se entiende valores entre 1-3 dolor leve, entre 4-7 dolor moderado y mayor de 7 dolor severo.
La evaluación del aspecto psicológico se realiza mediante la HADS. Esta escala, adaptada y validada en español, es utilizada en el ámbito ambulatorio. Está compuesta por 14 ítems, agrupando dos escalas. La subescala de ansiedad, con 7 ítems, se centra en el estudio de manifestaciones puramente psíquicas. La subescala de depresión, también con 7 ítems, se centra en aspectos más personales. El paciente responde las preguntas en base a la intensidad del síntoma o a la frecuencia de presentación del mismo, oscilando entre 0 (nunca, ninguna intensidad) a 3 (casi todo el día, muy intenso). La puntuación obtenida en cada subescala se interpreta según los criterios:
• De 0 a 7: rango de la normalidad.
• De 8 a 10: caso probable.
• De 11 a 21 caso de ansiedad o depresión.
Los ítems de esta escala incluyen aspectos cognitivos, emocionales y analizan comportamientos de la ansiedad y la depresión, sin tener en cuenta aspectos somáticos ligados con el proceso clínico que puedan generar resultados falsos positivos.
Análisis estadístico. Se ha llevado a cabo utilizando el programa informático SPSS versión 26.0. Para cada variable cuantitativa se ha calculado la media y desviación típica o media y rango. En el caso de las variables cualitativas se ha expresado la distribución de datos por frecuencias y porcentajes, analizando la dispersión de las mismas. En el caso de variables continuas, se estimó la normalidad mediante el test Kolmogorov-Smirnov.
Las pruebas cuantitativas se analizaron mediante el estudio del coeficiente de correlación de Pearson. Las diferencias entre variables fueron evaluadas mediante análisis ANOVA con correcciones post hoc Bonferroni. Se han considerado relaciones estadísticamente significativas a valores de la p inferiores a 0,05.
RESULTADOS
Nuestra muestra incluyó 15 pacientes con diagnóstico de EM definitiva. La edad media fue de 57,4±10,05 años, con edad media de diagnóstico de EM de 47,47±11,66 años. El 60 % de los pacientes fueron hombres.
La media de años de evolución de la EM al momento del estudio es de 9,93±10,01 años (rango: 1-35). Aparece de manera bilateral en el 13,3 % de los pacientes y unilateralmente en 86,7%, siendo predominante en el oído derecho (46,7%).
La clínica aparece de manera sincrónica en el 40% de los casos, es decir, al diagnóstico presentaban hipoacusia, acúfenos y plenitud ótica. En el 60% restante, los síntomas fueron metacrónicos.
El estudio de hipoacusia determina que el 60% de los pacientes presenta un grado de pérdida de audición moderado, mientras la pérdida es leve en el 20% y severa en el 20% (Figura 1).
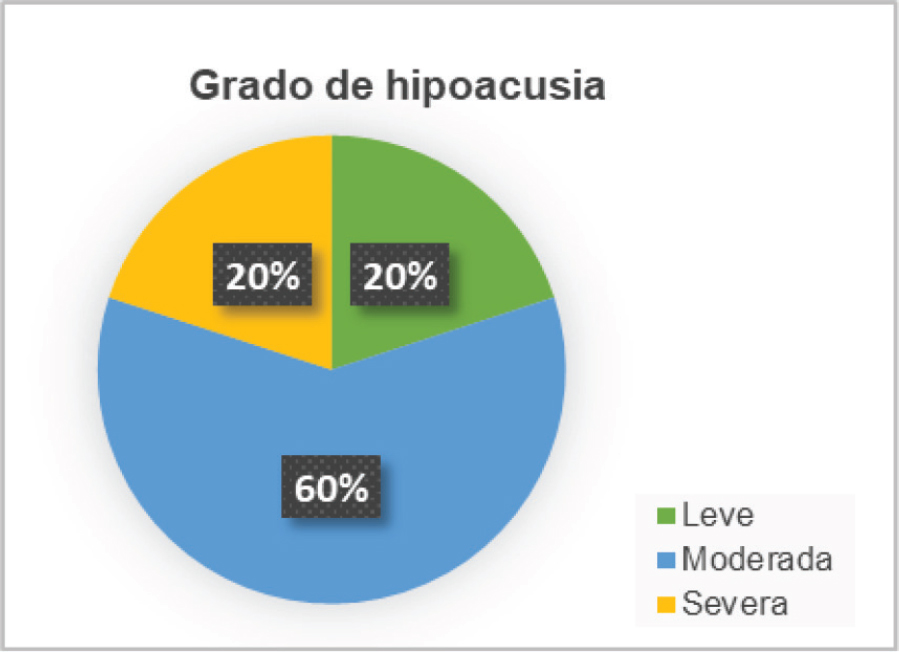
Figura 1. Distribución de la muestra según grado de hipoacusia.
La media de la pérdida auditiva en todas las frecuencias del oído izquierdo tuvo un valor de 35,29±20,82 dB (Rango: 4-71) y en el oído derecho 39,79±19,12 dB (Rango: 10-72), (p>0,05).
La media de pérdida auditiva en cada frecuencia se sitúa en torno a los 50 dB (Figura 2).
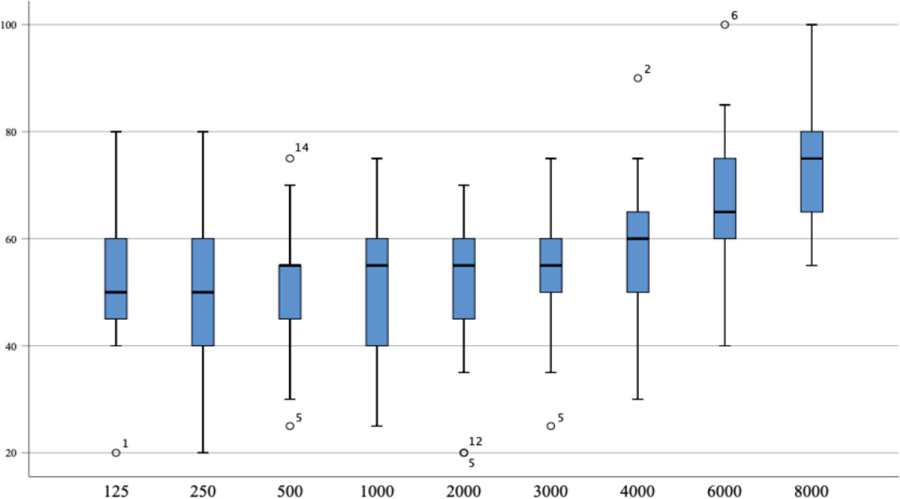
Figura 2. Pérdida de audición para cada frecuencia en el oído afectado por la enfermedad de Ménière.
En cuanto al acúfeno, la edad media de inicio fue de 49,40±11,66 años y una evolución media de 7,93±5,92 años. Los acúfenos fueron unilaterales en el 93,3% de los pacientes y bilaterales en el 6,7%.
En nuestra cohorte, 10 pacientes perciben el acúfeno en frecuencias graves (7 en 125 Hz y 3 en 500 Hz). De los 5 restantes, 1 percibe el acúfeno a 4000 Hz y en 4 a 8000 Hz.
Analizando los datos obtenidos en la acufenometría, la intensidad media del acúfeno es de 18,45±23,89 dB (Rango: -10 - 73 dB) y el umbral de enmascaramiento necesario para dejar de percibirlo de 5,45±10,44 dB (Rango: -22-19).
El THI determina una media de 35,07±24,29 puntos (Rango: 8-76). Siendo ésta una valoración subjetiva, no se correlacionó con los valores de PTA en el oído derecho (p=0,251) ni en el oído izquierdo (p=0,247).
La puntuación media de la escala VAS es de 5,93±1,58 puntos (Rango: 3-8).
Se determinó una correlación fuertemente significativa entre los valores obtenidos en THI y VAS para cada paciente (r=0,72; p<0,01). Sin embargo, no se encontró relación entre la puntuación de la VAS y el PTA del oído derecho (p=0,269) ni del oído izquierdo (p=0,375); al igual que lo sucedido con el THI.
En el HADS se obtuvo una puntuación media en la subescala de ansiedad de 5,40±2,746 puntos (Rango: 1-10) y en la de depresión de 3,87±3,72 puntos (Rango: 0 -10). Hubo correlación significativa entre la subescala de depresión y la puntuación obtenida en THI (r=0,53; p=0,042), pero no entre ésta y la subescala de ansiedad (p >0,05).
Los pacientes se separaron en dos grupos según los años de evolución de la enfermedad de Ménière; encontrándose una correlación fuertemente significativa entre la puntuación de THI y la subescala de depresión en pacientes con una evolución de la enfermedad superior a 2 años (r= 0,821; p=0,001).
En el caso de clasificar los pacientes según los años de evolución de los acúfenos, encontramos una relación estadísticamente significativa entre aquellos con acúfenos de más de 2 años de evolución y una puntuación más elevada tanto en THI como en las dos subescalas del HADS: de depresión (r=0,72; p=0,008) y de ansiedad (r=0,596; p=0,041). Este hallazgo no se encuentra en pacientes con menos de 2 años de evolución de su acúfeno (Figura 3).
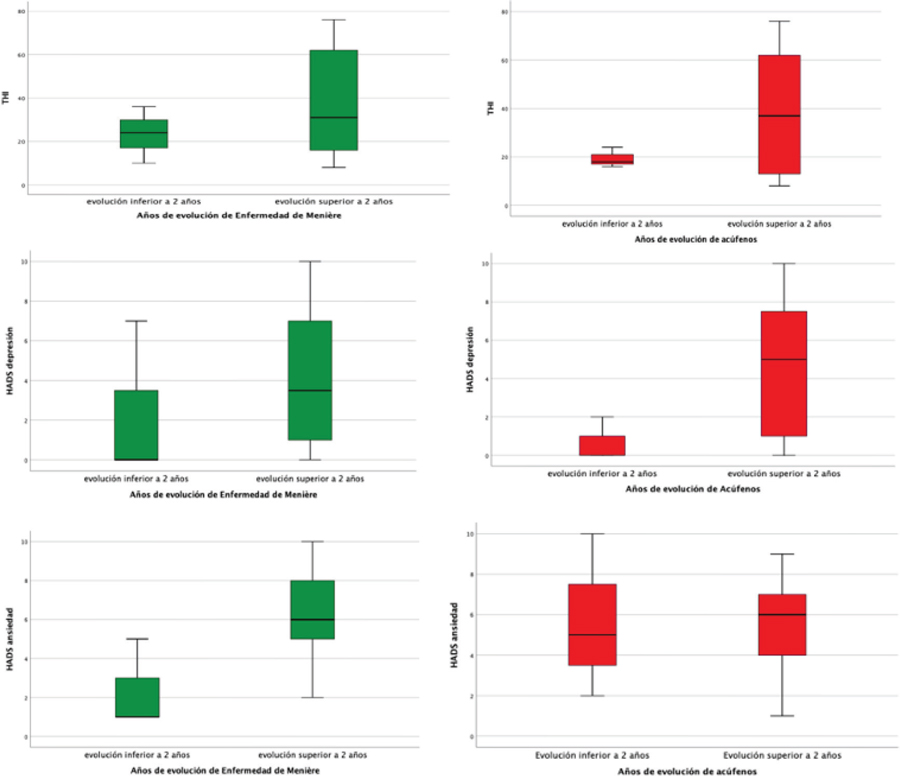
Figura 3. Representación de puntuaciones obtenidas en escala THI, HADS subescala depresión y subescala ansiedad segregando la muestra según los años de evolución de la Enfermedad de Ménière (izquierda) y años de evolución del acúfeno (derecha).
DISCUSIÓN
Las puntuaciones del THI se asocian estadísticamente con las obtenidas en la VAS; en cambio, dichas escalas no se relacionan con los valores de PTA de estos pacientes. Por tanto, no se objetivó una correlación clínica entre la pérdida auditiva y la intensidad subjetiva del acúfeno.
Debido a la implicación del acúfeno en el desarrollo de alteraciones del estado de ánimo, sería necesario aplicar en pacientes con EM una evaluación psicológica atendiendo de manera especial a su calidad de vida.
La bilateralidad en la Enfermedad de Ménière se recoge con grandes diferencias entre autores, en el caso de este estudio se encuentra un 13,3%, siendo lo habitual entre el 30 y el 40%.
Una fortaleza de nuestro estudio es la presencia de valores de PTA entre 35 dB del oído izquierdo y 39,5 dB del oído derecho, demostrando que ambos poseen un nivel semejante de daño auditivo. Al inicio de la enfermedad, la hipoacusia aparece sobre todo en las frecuencias graves, siendo de carácter fluctuante. Al progresar la misma, se van afectando las frecuencias agudas y el paciente presenta una curva de audiometría plana o pantonal [20, 21].
Lo habitual es que la evolución del acúfeno acompañe al curso de la enfermedad, es decir, la hipoacusia, acúfenos y plenitud ótica se manifiestan de manera conjunta [22, 23]; similar a otras publicaciones [17, 24], en el 40% de los pacientes del estudio la triada de síntomas se presentó de manera simultánea al inicio de la EM.
Los pacientes presentan acúfenos desde intensidades casi inapreciables hasta intensidades altas de 73 dB, lo que nos muestra el carácter tan heterogéneo del mismo [25].
La frecuencia a la cual se percibe el acúfeno se sitúa en la mayoría de los pacientes en tonos graves, de 125 a 500 Hz, que son las frecuencias más comúnmente afectadas [7, 17]. El acúfeno de tonalidad aguda se tolera peor por parte de los pacientes [26].
Los datos obtenidos en el estudio son congruentes con la pérdida de audición característica de la EM en frecuencias bajas. Además, los pacientes mayores a 60 años, la pérdida de audición se presentan también en frecuencias agudas, hecho característico del envejecimiento auditivo.
La adaptación española del THI y sus subescalas (funcional, emocional, catastrófica) muestra fiabilidad y consistencia interna elevada; de manera que puede ser utilizada para cuantificar el impacto del acúfeno en la vida diaria del paciente [25].
La puntuación del THI no se relacionó con el grado de pérdida auditiva. Pese a ello, algunos estudios destacan que una mayor afectación coclear puede intensificar la percepción del acúfeno y en casos de pérdida auditiva más marcada, el umbral de enmascaramiento necesario para dejar de percibir el acúfeno es menor [26]. Sin embargo, otros estudios apuntan que los pacientes con audición normal pueden tener más molestias que los que tienen pérdida auditiva debido a la mayor intrusión del acufeno [19].
En pacientes con EM de larga duración, el acúfeno fue la principal razón de su malestar [27]. Esto se debe a que en fases avanzadas de la enfermedad se dejan de presentar crisis de vértigo y la pérdida de audición se estabiliza.
En nuestro estudio, existe una relación fuertemente significativa entre los valores obtenidos en la VAS y THI. Algunos autores concluyen de esta relación que cuanto más intensamente perciben los pacientes el acúfeno, más limita sus actividades y mayor impacto tiene en su calidad de vida [26].
Las puntuaciones obtenidas en ambas escalas subjetivas no se relacionaron con los valores de PTA del paciente en ninguno de los oídos, por tanto, la incomodidad debida al acúfeno no se puede atribuir a la pérdida auditiva. Contrario a nuestros resultados, Ratnayake et al. [28] sugieren que la subyacente pérdida de audición puede jugar un papel en las molestias por el acúfeno. No ha sido así en nuestro estudio, hecho atribuible quizás a contar con una muestra pequeña.
Varios son los estudios que han determinado la relación del acúfeno con problemas emocionales, principalmente ansiedad y depresión y con problemas cognitivos como dificultad en la concentración y atención [29, 30]. En cambio, el déficit auditivo no influía en estas actividades [31].
Los problemas emocionales se consideran consecuencia de la enfermedad [32] pero los factores psicológicos derivados podrían empeorar la percepción de los propios síntomas de la enfermedad [33, 34], dando lugar de esta manera a un círculo vicioso.
En nuestro estudio, se ha determinado la existencia de una relación significativa entre el grado de depresión y THI, pero no se encontró relación con el grado de ansiedad. Los pacientes con una mayor evolución en años, presentan peor resultado en la escala HADS. La larga evolución de la EM se asocia a depresión, mientras que la ansiedad podría relacionarse con etapas precoces [35].
Numerosos estudios publicados apoyan estos resultados siendo la depresión el único factor con relación significativamente estadística con THI [15, 17, 19, 26], considerando la EM un trastorno vestibular periférico crónico con comorbilidades psiquiátricas [36].
Existe una elevada prevalencia de depresión a lo largo de la vida de los pacientes con acúfeno crónico, en torno al 60-80% [37, 38].
La duración de la enfermedad no tiene relación significativa con puntuaciones en las subescalas de ansiedad y depresión [15]. Definitivamente, lo importante son los años de evolución del acúfeno.
El trastorno del ánimo comienza simultáneamente con la aparición del acufeno [39]. Se puede relacionar puntuaciones más elevadas en THI, VAS y HADS en pacientes con aparición del acúfeno de manera precoz [40].
La sintomatología depresiva asociada a la EM hace preciso un análisis multidisciplinar, haciendo hincapié en los factores psicosociales y si es necesario, someter a los pacientes a un examen diagnóstico de trastornos psiquiátricos [6, 41].
Por otro lado, el factor con más impacto en la percepción de la discapacidad en pacientes con EM es la presencia de una continua inestabilidad a pesar de no ser uno de los síntomas principales de la enfermedad. Por tanto, se recomienda utilizar clasificaciones que tengan en cuenta también los síntomas vestibulares [42].
El estudio de la discapacidad en la EM debe reflejar la situación psicológica del paciente, así como características familiares, laborales y sociales [6]. Estos datos apoyan la eficacia de la terapia cognitivo conductual en el tratamiento del acúfeno de estos pacientes [43].
La afectación de la EM presenta gran heterogeneidad clínica y eso conlleva grandes diferencias en la respuesta al tratamiento; el cual, no debe centrarse solamente en la patología, sino también en los trastornos emocionales, siendo útil el manejo personalizado de la enfermedad para el control de los síntomas [44]. La identificación y tratamiento de la depresión podrían mejorar la calidad de vida general de los pacientes con la EM [36].
CONCLUSIONES
• El acúfeno es inherente a la enfermedad de Ménière pero presenta gran heterogeneidad entre pacientes, lo que dificulta tanto su diagnóstico como su abordaje terapéutico.
• La intensidad del acúfeno, cuantificada de manera subjetiva con THI, no se relaciona con el grado de pérdida auditiva en los pacientes con enfermedad de Ménière.
• Los valores de PTA de ambos oídos no se relacionaron con las puntuaciones de THI ni VAS, no pudiendo atribuir a la pérdida auditiva la incomodidad debida al acúfeno.
• En la mayoría de los casos, los pacientes perciben el acúfeno en tonos graves (125-500 Hz), siendo las frecuencias más afectadas en la enfermedad de Ménière.
• Los resultados obtenidos en las escalas VAS pueden extrapolarse a los de THI. Esto aporta validez al uso de la escala VAS en consulta, siendo de rápida aplicación y fácil comprensión por parte del paciente. Ambas escalas permiten evaluar el grado de intrusión del acúfeno en la vida del paciente.
• Los condicionantes emocionales presentan gran relevancia en los pacientes con enfermedad de Ménière. Los pacientes con intensas molestias por el acúfeno presentaron puntuaciones altas en THI, VAS y HADS asociando además una aparición temprana del mismo. Peores resultados en la escala HADS a expensas de la subescala de depresión se relacionaron con la presencia de acúfenos de más de dos años de evolución.
• El tratamiento de la enfermedad de Ménière debe ser personalizado buscando predictores que detecten de manera precoz las molestias debidas al acúfeno para así reducir su impacto en la calidad de vida del paciente.
BIBLIOGRAFÍA
1. Herraiz C, Tapia MC, Plaza G. Tinnitus and Ménière’s disease: Characteristics and prognosis in a tinnitus clinic sample. Eur Arch Oto-Rhino-Laryngology. 2006;263(6):504-509.
2. Lopez-Escamez JA, Carey J, Chung WH, Goebel JA, Magnusson M, Mandalà M. Criterios diagnósticos de enfermedad de Ménière: Documento de consenso de la Bárány Society, la Japan Society for Equilibrium Research, la European Academy of Otology and Neurotology (EAONO), la American Academy of Otolaryngology-Head and Neck Surgery (AAO-HNS) y la Korean Balance Society. Acta Otorrinolaringol Esp. 2016;67(1):1–7.
3. Basura GJ, Adams ME, Monfared A, Schwartz SR, Antonelli PJ, Burkard R. Clinical Practice Guideline: Ménière’s Disease. Otolaryngol - Head Neck Surg (United States). 2020;162(2_suppl): S1–55.
4. La enfermedad de Ménière [Internet]. NIDCD. 2020 [consultado 26 Ag 2020]. Disponible en: https://www.nidcd.nih.gov/es/espanol/la-enfermedad-de-meniere
5. Vazquez-Muñoz M, Gomez-Tapiador P, Oliva-Dominguez M. Síndromes Vestibulares Periféricos: Enfermedad De Meniere, Neuronitis Vestibular, Vértigo Posicional Paroxístico Benigno. Cirugía Del Vértigo. Acta Otorrinolaringol Esp. 2015; 1:21-29.
6. Pérez H, López J, Morales C, Fernández NP. Enfermedad de Ménière: desde las ciencias básicas hacia la medicina clínica. En: LX Congreso Nacional de la Sociedad Española de Otorrinolaringología y Patología Cervicofacial. Ediciones Médicas; 2009; 85–92
7. Vernon J, Johnson R, Scheuning A. The characteristics and natural history of tinnitus in Meniere’s disease. Otolaryngol Clin North Am. 1980; 13: 611-619.
8. Manuel Morales Puebla J, María Mingo Sánchez E, Miguel Menéndez Colino L. Exploración y Tratamiento del paciente con Acúfenos. En: Libro virtual de formación en ORL. Sociedad Española de Otorrinolaringología; 1996;1–30
9. Yoshida T, Stephens D, Kentala E, Levo H, Auramo Y, Poe D. Tinnitus complaint behaviour in long-standing Ménière’s disorder: Its association with the other cardinal symptoms. Clin Otolaryngol. 2011;36(5):461–467.
10. Perez-Carpena P, Martinez-Martinez M, Martínez Carranza RA, Batuecas-Caletrio A, Lopez-Escamez JA. A tinnitus symphony in 100 patients with Meniere’s disease. Clin Otolaryngol. 2019;44(6):1176-1180.
11. Peña Martínez A. Evaluation of discapacity generated by tinnitus: national linguistichomologation of Tinnitus Handicap Inventory (THI) Handicap Evaluation in Tinnitus Patients: a national linguistic adaptation. Rev Otorrinolaringol y cirugía cabeza y cuello. 2006;66(3):232–235.
12. Crummer RW, Hassan GA. Diagnostic Approach to Tinnitus - American Family Physician. Am Acad Fam Physicians. 2004; 69:120-126.
13. Zhang Y, Liu B, Wang R, Jia R, Gu X. Characteristics of the cochlear symptoms and functions in Meniere’s disease. Chin Med J (Engl). 2016;129(20):2445-2450.
14. Yardley, L., Dibb, B. and Osborne, G. (2003), Factors associated with quality of life in Ménière’s disease. Clin Otolaryngolog. 2003; 28: 436-441
15. Stephens D, Pyykkö I, Yoshida T, Kentala E, Levo H, Auramo Y. The consequences of tinnitus in long-standing Ménière’s disease. Auris Nasus Larynx. 2012;39(5):469–474.
16. Rosini DCE, Marconi MLCPL. Ménière ’s disease and anxiety disorders. Acta Otorhinolaryngol Ital. 2003; 23: 421- 427.
17. Havia M, Kentala E, Pyykkö I. Hearing loss and tinnitus in Meniere’s disease. Auris Nasus Larynx. 2002; 29(2):115–119.
18. Arroll M, Dancey CP, Attree EA, Smith S, James T. People with symptoms of Ménière’s disease: The relationship between illness intrusiveness, illness uncertainty, dizziness handicap, and depression. Otol Neurotol. 2012;33(5):816–823.
19. Pajor AM, Ormezowska EA, Jozefowicz-Korczynska M. The impact of co-morbid factors on the psychological outcome of tinnitus patients. Eur Arch OtoRhinoLaryngology. 2013; 270(3): 881–888.
20. Lee CS, Paparella MM, Margolis RH, Le C. Audiological profiles and Meniere’s disease. Ear Nose Throat J 1995; 74(8): 527-532.
21. Mancini F, Catalani M, Carru M, Monti B. History of Meniere’s disease and its clinical presentation. Otolaryngol Clin North Am 2002; 35(3):565-580.
22. Sajjadi H, Paparella MM. Meniere’s disease. Lancet. 2008;372(9636):406-14.
23. Filipo R, Barbara M. The natural course of Meniere´s disease. Proc 3rd International Symposium on Meniere’s disease. Amsterdam: Kugler; 1994: 9-20
24. Stahle J, Friberg U, Svedberg A. Long-term progression of Meniere’s disease. Acta Otolaryngol Suppl 1991; 485:78-83.
25. Herraiz C, Hernandez Calvin J, Plaza G, Tapia MC, De los santos G. Evolución de la incapacidad en pacientes con acúfenos. Acta Otorrinolaringológica Española. Elsevier. 2001; 52(6): 534-538
26. Romero Sánchez I, Pérez Garrigues H, Rodríguez Rivera V. Clinical characteristics of tinnitus in Ménière’s disease. Acta Otorrinolaringol (English Ed) 2010;61(5):327–31.
27. Hägnebo C., Melin L., Larsen H. et al. The influence of vertigo, hearing impairment and tinnitus on the daily life of Meniere’s patients. Scand. Audiol. 1997; 26, 69–76
28. Ratnayake SA, Jayarajan V, Bartlett J. Could an underlying hearing loss be a significant factor in the handicap caused by tinnitus? Noise Health 2009; 11:156–160
29. Halford JBS, Anderson SD. Anxiety and depression in tinnitus sufferers. J Psychosom Res 1991; 35:383–390
30. Stephens SDG, Hallam RS. The Crown–Crisp Experiential Index in patients complaining of tinnitus. Br J Audiol 1985; 19:151–158
31. Stevens C, Walker G, Boyer M, Gallagher M. Severe tinnitus and its effect on selective and divided attention. Int J Audiol. 2007; 46:208-216
32. House JW, Crary WG, Wexler M. The inter-relationship of vertigo and stress. Otolaryngol Clin North Am. 1980; 4:625-629.
33. Groen JJ. Psychosomatic Aspects of Ménière’s Disease. Acta Otolaryngol. 1983; 95:407-16.
34. Hinchcliffe R. Emotion as Precipitating Factor in Ménière’s Disease. J Laryngol Otol. 1967; 81:477-81.
35. Pollak L, Klein C, Rafael S, Vera K, Rabey JM. Anxiety in the First Attack of Vertigo. Otolaryngology-Head Neck Surgery 2003; 128:829-34.
36. Patel JJ, Levy DA, Nguyen SA, Rizk HG, Meyer TA. Depression in Ménière’s disease: a systematic review and meta-analysis. The Journal of Laryngology & Otology. Cambridge University Press. 2020;134(4):293–301.
37. Sullivan MD, Katon W, Dobie R, Sakai C, Russo J, Harrop-Griffiths J. Disabling tinnitus. Association with affective disorder. Gen Hosp Psychiatry. 1988; 10(4):285–291.
38. Ziai K. Tinnitus Patients Suffering from Anxiety and Depression: A Review. 2017;21(1):68–73.
39. Andersson G, Baguley DM, McKenna L, McFerran D. Tinnitus. A multidisciplinary approach. Second Edition. London: Whurr; 2005.
40. Maas IL, Brüggemann P, Requena T, Bulla J, Edvall NK, Hjelmborg JVB, Genetic susceptibility to bilateral tinnitus in a Swedish twin cohort. Genet Med 2017;19(9):1007–1012.
41. Eckhardt-henn A, Best C. Psychiatric comorbidity in different organic vertigo syndromes. J Neurol. 2008;420-428.
42. Soto-Varela A, Gayoso-diz BHP. Disability perception in Ménière´s disease: when, how much and why? Eur Arch OtoRhinoLaryngology. 2016;273(4):865–72.
43. Bhatt JM, Bhattacharyya N, Lin HW. Relationships between tinnitus and the prevalence of anxiety and depression. Laryngoscope 2007; 7;127(2):466–469.
44. Wu P, Wang H, Wu Z. The assessment of anxiety and depression state in Meniere’s disease patients. Lin Chung Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2012; 26: 516–8.